6月26日,国际学术期刊Theranostics(中科院1区Top,影响因子IF=12.4)在线发表了西北师范大学李烨华研究组与中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)赵允研究组以及复旦大学生命科学学院周兆才教授题为“Sufu limits sepsis-induced lung inflammation via regulating phase separation of TRAF6”的最新研究成果。该项工作揭示了Hedgehog (Hh)信号通路相关蛋白Sufu通过调控E3泛素蛋白连接酶TRAF6液-液相分离从而调控败血症相关的肺部炎症反应的分子机制。
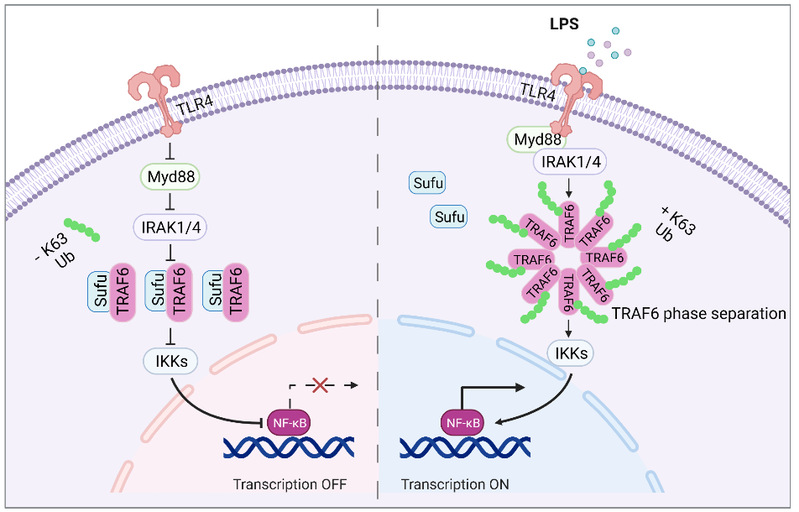
败血症是一种由各种致病菌侵入血液循环,产生毒素而发生的急性全身性感染疾病。败血症通常是由先天免疫激活引起的,其中Toll样受体(Toll-like receptors, TLRs)中的TLR4受体通过识别细胞膜上脂多糖(LPS)的存在并激活炎症反应。TRAF6作为固有免疫信号通路中重要的E3素连接酶,广泛参与包括TLR、RLR、NLR等介导的固有免疫反应过程。TRAF6在广泛的生理和病理过程以及在固有免疫、适应性免疫、炎症和组织稳态等方面均发挥关键调控作用。因此,机体对于TRAF6活性的正确调控相当关键。
以往有关TRAF6活性调控的大量研究集中TRAF6自身或者底物K63连接的泛素化水平的抑制或者抑制其与发挥活性所必须的蛋白的结合。本研究中,研究人员发现在巨噬细胞介导的免疫应答中,TRAF6能够以液-液相分离形式发挥其活性,且其聚态变化受到Hh信号通路中经典负调控因子Sufu动态调节。在LPS激活的TLR4信号通路中,Sufu动态相应LPS刺激,通过与TRAF6结合抑制其相分离及自身泛素化,进而抑制败血症相关的肺部炎症反应。
本研究通过体内与体外实验,鉴定Hh信号通路相关蛋白Sufu是TLR4通路的新炎症反应型调节因子,阐明了Hh通路相关蛋白Sufu在炎症反应中的功能,并首次揭示TRAF6液-液相分离活性调控的新型机制。以上研究结果以Hh与TLR4信号通路的交叉融合为着眼点,聚焦Hh 信号通路相关蛋白Sufu调控下的TRAF6液-液相分离在机体免疫中的功能调控机制,建立以Sufu-TRAF6为核心的Hh与炎症免疫的分子信号联系,为以TRAF6为靶点的临床诊治及药物筛选提供科学依据。
西北师范大学副教授李烨华和中国科学院分子细胞科学卓越创新中心彭甲银副研究员为该论文共同第一作者。中国科学院分子细胞科学卓越创新中心赵允研究员和复旦大学生命科学学院周兆才教授为该论文共同通讯作者。该工作得到国家重点研发计划、基金委、上海市以及甘肃省自然科学基金的经费资助。
文章链接:https://www.thno.org/v13p3761.htm

